近日,口腔醫學院(口腔醫院)葛少華教授、李建華教授口腔生(shēng)物材料研究團隊,圍繞口腔感染和組織再生(shēng)臨床問題,在基于金(jīn)屬多酚配位網絡的生(shēng)物活性界面研究方面取得系列新(xīn)進展,成果分(fēn)别發表在ACS Nano(IF=17.1)、Nano Energy(IF=17.5)、Advanced Science(IF=16.7)上(shàng)。山東大學口腔醫學院均爲第一(yī)完成單位。
進展一(yī):發現多酚配體-金(jīn)屬電荷轉移具有界面類酶催化(huà)行爲,用于慢(màn)性傷口愈合
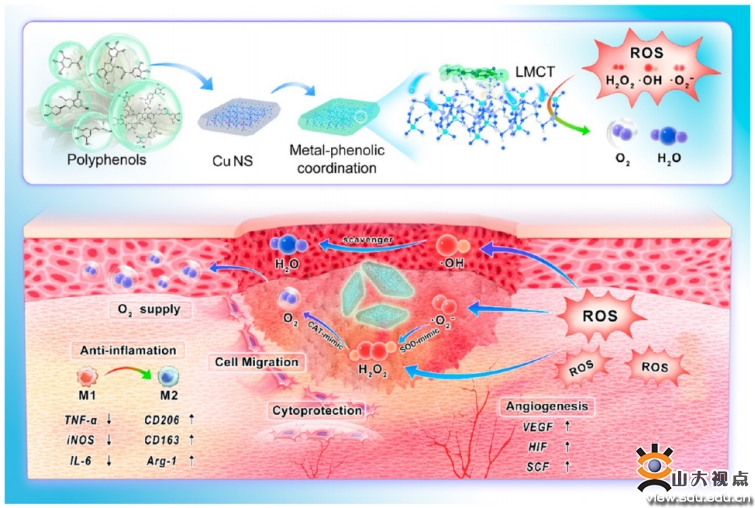
慢(màn)性傷口是糖尿病的一(yī)種常見并發症,可導緻感染、截肢、殘疾,甚至死亡等嚴重後果,對人(rén)類健康危害嚴重。身(shēn)體長期處于高血糖狀态導緻傷口組織活性氧(ROS)增加,氧化(huà)還原平衡被破壞從而加劇了(le)炎症反應,傷口修複過程所必需的細胞血管生(shēng)成和遷移等功能(néng)也(yě)被損害,最終阻礙傷口愈合。團隊提出了(le)一(yī)種由多酚配體-金(jīn)屬電荷轉移(LMCT)誘導的2D銅抗氧化(huà)納米酶,該納米酶由單甯酸TA和磷酸銅納米片化(huà)學配位形成,以消除ROS并促進慢(màn)性糖尿病傷口愈合。該研究發現,銅納米片上(shàng)配位的多酚配體會使界面處具有較強的電荷轉移能(néng)力,并能(néng)調節Cu的價态,TA配位還可以減輕直接使用Cu納米材料的細胞毒性作(zuò)用。同時該納米酶對不同的氧化(huà)物種表現出有效的清除能(néng)力,通過分(fēn)解ROS保護細胞免受氧化(huà)損傷,并能(néng)通過促進上(shàng)皮再生(shēng)、膠原沉積、血管生(shēng)成和免疫調節來促進糖尿病傷口的愈合。這項工作(zuò)證明了(le)基于多酚配體的LMCT在納米界面上(shàng)誘導的類酶清除ROS能(néng)力,爲構建用于治療糖尿病傷口和其他疾病的金(jīn)屬基納米酶提供了(le)一(yī)種新(xīn)的策略。相關研究成果以“Phenolic Ligand-Metal Charge Transfer Induced Copper Nanozyme with Reactive Oxygen Species-Scavenging Ability for Chronic Wound Healing”爲題,發表在國際期刊ACS Nano上(shàng),葛少華教授、李建華教授爲共同通訊作(zuò)者,學院(醫院)博士研究生(shēng)陳意爲第一(yī)作(zuò)者。
進展二:金(jīn)屬多酚配位界面介導胞内遞送納米壓電催化(huà),構建mROS啓發的工程化(huà)巨噬細胞,用于感染清除
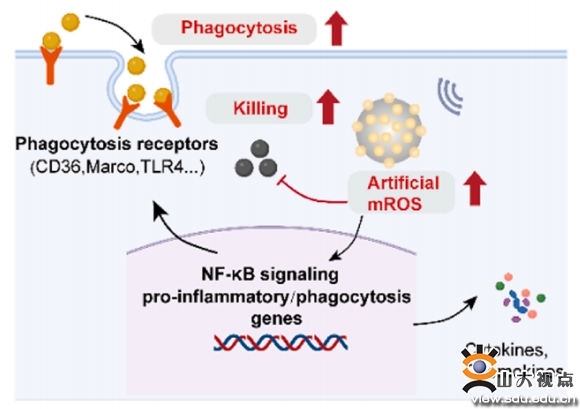
每年全球約數百萬人(rén)死于細菌感染,其中因金(jīn)黃色葡萄球菌(S. aureus)感染死亡的占比最大,可引起敗血症、肺炎、皮膚軟組織感染等疾病。現有傳統的治療金(jīn)葡菌感染的方法包括物理(lǐ)清除和抗生(shēng)素治療,這可能(néng)導緻清除不徹底、清除過度損傷組織或出現耐藥性。巨噬細胞等人(rén)類先天免疫細胞是宿主抵禦細菌感染的第一(yī)道防線,線粒體活性氧(mROS)在巨噬細胞的免疫反應中起重要作(zuò)用。然而,S. aureus已經進化(huà)出抑制mROS生(shēng)成等多種逃避免疫系統攻擊的防禦策略,使細菌長期在體内存活。
團隊提出了(le)具有人(rén)工mROS生(shēng)成能(néng)力的納米壓電工程化(huà)巨噬細胞的概念。這一(yī)概念通過金(jīn)屬多酚網絡(MPN)介導的溶酶體逃逸和增強的細胞内壓電催化(huà)實現。MPN是一(yī)種由多酚配體和金(jīn)屬離子(zǐ)自組裝形成的超分(fēn)子(zǐ)網絡,具有電荷和質子(zǐ)緩沖能(néng)力,可以在進入細胞之前阻斷納米壓電的ROS産生(shēng),确保其脫靶生(shēng)物安全性。當被巨噬細胞内化(huà)後,MPN可以在溶酶體内誘導質子(zǐ)“海綿效應”,從而通過溶酶體逃逸将納米壓電催化(huà)輸送到細胞質。在超聲條件下(xià),壓電工程化(huà)巨噬細胞表現出對S. aureus增強的吞噬作(zuò)用和較強的殺菌活性。通過靶向配體修飾的納米壓電納米顆粒在感染部位原位工程化(huà)巨噬細胞,對S. aureus膿腫感染模型中展現出來較好(hǎo)(hǎo)的治療效果。這項研究揭示了(le)細胞内壓電納米催化(huà)在增強巨噬細胞先天免疫反應方面的潛力,爲巨噬細胞介導的免疫療法提供了(le)一(yī)種非侵入性治療思路(lù)。相關研究成果以“Intracellular delivery of piezotronic-dominated nanocatalysis to mimic mitochondrial ROS generation for powering macrophage immunotherapy”爲題,發表在國際期刊Nano Energy上(shàng),葛少華教授、李建華教授、劉宏教授爲共同通訊作(zuò)者,學院(醫院)碩士研究生(shēng)馮俊昆爲第一(yī)作(zuò)者。
進展三:金(jīn)屬多酚配位界面調節早期免疫,增強口腔钛種植體骨整合
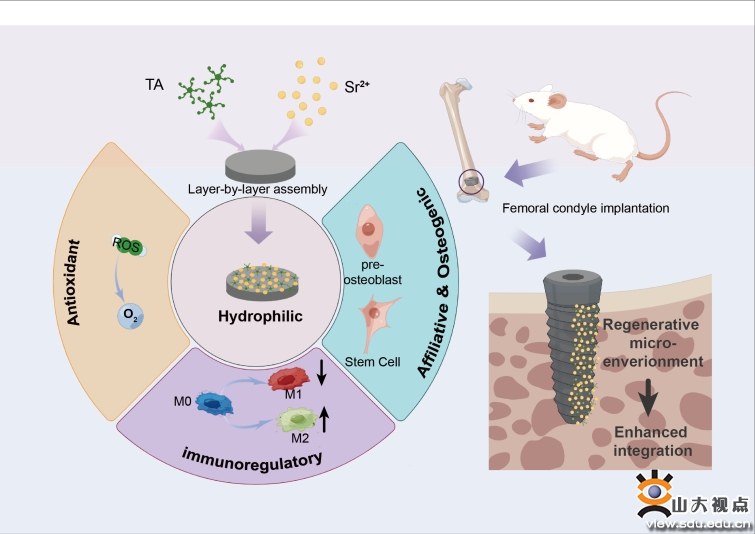
針對口腔種植修複過程中種植體植入後異常免疫應答(dá)導緻骨結合不良問題,團隊成功在醫用钛合金(jīn)表面原位構建了(le)多酚-锶(TA-Sr)配位多功能(néng)納米塗層。該塗層具有良好(hǎo)(hǎo)的表面适應性、生(shēng)物相容性、親水性以及優異的自由基清除能(néng)力,并能(néng)持續釋放(fàng)Sr2+促進成骨分(fēn)化(huà)并誘導礦化(huà)形成更多骨質較佳的新(xīn)骨,增強種植體與宿主骨結合效果。同時該研究發現含有TA-Sr塗層的種植體植入後可調控巨噬細胞,抑制其向M1型極化(huà)并誘導M2型極化(huà),這種在種植早期對周圍免疫微環境的調控,可明顯縮短種植後的炎症浸潤過程加速骨愈合,使新(xīn)骨礦化(huà)的效率顯著提升。團隊合作(zuò)成果近期以“A Multifunctional Metal-Phenolic Nanocoating on Bone Implants for Enhanced Osseointegration via Early Immunomodulation”爲題,發表在國際期刊Advanced Science上(shàng),葛少華教授、李建華教授,北京大學口腔醫學院韓建民(mín)教授爲共同通訊作(zuò)者,學院(醫院)劉金(jīn)爲第一(yī)作(zuò)者。
近年來,口腔醫學院(口腔醫院)高度重視學科交叉融合,主動對接國家戰略需求,充分(fēn)利用學校(xiào)學科門類齊全優勢,大力推進“口腔+X”團隊攻關,取得了(le)一(yī)系列交叉研究成果。葛少華、李建華教授口腔生(shēng)物材料研究團隊緻力于新(xīn)型生(shēng)物材料在口腔基礎醫學領域的基礎和應用研究,研究成果發表在Adv Funct Mater(2023)、ACS Nano (2024, 2023)、Adv Sci(2024, 2021)、Nano Energy(2024,2021)、Int J Oral Sci (2022)等。
上(shàng)述研究得到了(le)國家自然科學基金(jīn)、泰山學者、齊魯青年學者、山東省重點研發計劃(重大科技創新(xīn)工程)等基金(jīn)的支持。